ICH 于 6 月 3 日发布新闻稿介绍了其在 5 月 27 日举行的网络会议的一些进展,包括增加了新的成员和观察员,并且更新了正在制定中的指南进程。这次网络会议代替了原定在加拿大温哥华举行的会议。会上,ICH 首先欢迎了土耳其药品和医疗器械局(TITCK)成为监管成员,TITCK 于 2018 年作为观察员加入 ICH。另外,黎巴嫩公共卫生部(MOPH)成为新观察员。至此,ICH 成员总数已达 17 个,观察员有 32 个。
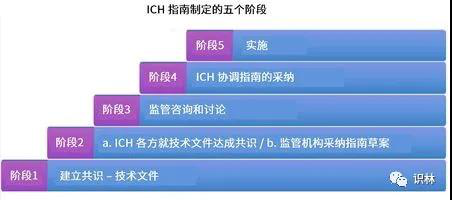
ICH 在会上还更新了四篇现有指南的进度,其中三篇已经在最近几个月进入第 4 阶段,一篇已进入第 2 阶段。进入第 4 阶段的指南包括:
· ICH M8 电子通用技术文件(eCTD)v4.0 指南的问答文档v1.3
· ICH 新的 S11 支持儿科药物开发的非临床安全试验【ICH 发布 S11 促进儿科试验并减少动物使用 2020/04/18】
· ICH S5(R3) 人用药物生殖毒性和发育毒性的检测【ICH 发布生殖毒性和发育毒性检测指南 2020/02/28】
包含三个新杂质每日允许暴露量的《Q3C(R8) 杂质:残留溶剂的指导原则》已在三月份进入第二阶段,我国药审中心也已于 4 月底发布中文翻译并公开征求意见。大会还表示支持有关两个新主题的工作,包括:M4Q(R1)通用技术文件(CTD)指南的修订和结构化产品质量提交。M4Q(R1) CTD 的工作预计将在 2020 年底成立一个非正式工作组后展开,并且计划就启动结构化产品质量提交起草一份计划,因为该主题是与 M4Q(R1) CTD 的工作是相辅相成的。此外,大会还表示支持建立讨论组,以进一步考虑与下面两个主题提案相关可能的新协调活动的范围和方法:支持药品注册的模型知情(Model-Informed)药物研发;以及ICH E4:支持药品注册所需的量效关系信息。
上一篇| 无